
Back Tegnesium Afrikaans ቴክኔቲየም Amharic Tecnecio AN تكنيشيوم Arabic طيكنيتيوم ARY تكنيشيوم ARZ Tecneciu AST Tcetiel AVK Texnesium Azerbaijani Технеций Bashkir
| Tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
43Tc
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gris metàl·lic brillant Injecció de 99mTc  Línies espectrals del tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Tecneci, Tc, 43 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 7, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 98(0) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Kr] 4d5 5s2 2, 8, 18, 13, 2 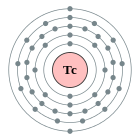
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
11 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 2.430 K, 2.157 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 4.538 K, 4.265 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 33,29 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 585,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,27 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor extrapolat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 7, 6, 5, 4, 3[1], 2, 1[2], -1, -3 (òxid àcid fort) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,9 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 702 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.470 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.850 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 136 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 147±7 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 50,6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 16,200 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-26-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del tecneci | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El tecneci (del grec, tekhnetos, 'artificial')[3] és un element químic de nombre atòmic 43 situat en el grup 7 de la taula periòdica dels elements. Se simbolitza com Tc. Es tracta d'un metall de transició, gris argentat, radioactiu, que només s'ha trobat en molt petites quantitats en la naturalesa (en un principi es va pensar que no existia en la naturalesa) i que s'obté de forma sintètica. La principal aplicació és en medicina, en tècniques de diagnosi.[4][5]
No té isòtops estables i, per tant, és molt estrany de trobar-lo en la naturalesa.
- ↑ «Technetium: technetium(III) iodide compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ «Technetium: technetium(I) fluoride compound data». OpenMOPAC.net. [Consulta: 10 desembre 2007].
- ↑ Setford, Steve. 1001 dades sobre la ciència. Molino, 2005. ISBN 9788427224773.
- ↑ Error de citació: Etiqueta
<ref>no vàlida; no s'ha proporcionat text per les refs nomenades:6 - ↑ «Technetium | Radioactive, Synthetic, Transition Metal» (en anglès). Britannica. [Consulta: 15 octubre 2023].