
Back Antikörper ALS ኣንቲቦዲ Amharic جسم مضاد Arabic প্ৰতিদেহ Assamese Antitel Azerbaijani Антыцелы Byelorussian Антитяло Bulgarian प्रतीदेह Bihari অ্যান্টিবডি Bengali/Bangla Antitijelo BS
 For alternative betydninger, se Antistof. (Se også artikler, som begynder med Antistof)
For alternative betydninger, se Antistof. (Se også artikler, som begynder med Antistof)


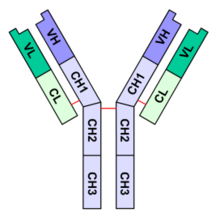




Antistoffer eller immunglobuliner er en vigtig del af kroppens immunforsvar mod fremmede organismer, primært bakterier, svampe, virus og parasitter.
Antistoffer er effektive, fordi de er specialiserede til at kunne "genkende" bestemte immunogener eller antigener, derfor reagerer de hurtigt og præcist når for eksempel en mikroorganisme genkendes. Første gang kroppen udsættes for et antigen dannes et antistof mod dette. Bliver kroppen angrebet igen, er antistofferne klar. Plasmacellerne producerer størsteparten af antistofferne.