
Back Bifosfoglicerat mutasa Catalan Bisphosphoglycerate mutase English Bisfosfoglicerato mutasa Spanish Bisfosfoglyseraattimutaasi Finnish Bisphosphoglycérate mutase French Bisfosfoglicerato mutasi Italian 비스포스포글리세르산 변위효소 Korean Bisfosfoglicerato mutase Portuguese Бисфосфоглицератмутаза Russian Bisfosfogliceratna mutaza Serbo-Croatian
| Bisphosphoglyceratmutase | ||
|---|---|---|
| ||
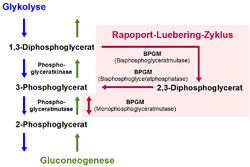
| Schematische Darstellung des Rapoport-Luebering-Zyklus mit den drei Enzymaktivitäten der Bisphosphoglyceratmutase | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 258 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | BPGM | |
| Externe IDs | ||
| Enzymklassifikationen | ||
| EC, Kategorie | 5.4.2.4, Phosphotransferase | |
| Reaktionsart | Umlagerung | |
| Substrat | 1,3-Bisphosphoglycerat | |
| Produkte | 2,3-Bisphosphoglycerat | |
| EC, Kategorie | 5.4.2.1, Phosphotransferase | |
| Reaktionsart | Umlagerung | |
| Substrat | 2-Phosphoglycerat | |
| Produkte | 3-Phosphoglycerat | |
| EC, Kategorie | 3.1.3.13, Phosphatase | |
| Reaktionsart | Hydrolyse | |
| Substrat | 2,3-Bisphosphoglycerat + H2O | |
| Produkte | 3-Phosphoglycerat + Phosphat | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
Die Bisphosphoglyceratmutase (BPGM), früher auch als 2,3-Diphosphoglyceratmutase bezeichnet, ist ein Enzym, das vor allem in den Erythrozyten (roten Blutkörperchen) und in erythropoetischem Gewebe von Säugetieren vorkommt. Sie ist in den roten Blutkörperchen das zentrale Enzym des Rapoport-Luebering-Zyklus, einem Nebenweg der Glykolyse, in welchem sie als trifunktionales Enzym drei verschiedene biochemische Reaktionen zur Bildung und zum Abbau von 2,3-Bisphosphoglycerat (2,3-BPG) katalysiert. 2,3-BPG ist als biochemischer Effektor an der Regulation der Bindungfähigkeit (Affinität) des Blutfarbstoffs Hämoglobin für das Atemgas Sauerstoff in den Erythrozyten beteiligt.