
Back Lisil oxidasa Catalan LOX Welsh Lysyl oxidase English Lisil oxidasa Spanish Lisil oksidase ID Protein-lisina 6-ossidasi Italian タンパク質-リシン-6-オキシダーゼ Japanese Oksydaza lizylowa Polish LOX Portuguese Protein-lizin 6-oksidaza Serbo-Croatian
| Lysyloxidase | ||
|---|---|---|
| ||
| Lysyloxidase homodimer, Komagataella pastoris nach PDB 1n9e | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 249 Aminosäuren | |
| Kofaktor | Cu++ | |
| Präkursor | Preprolysyloxidase (417 Aminosäuren) | |
| Bezeichner | ||
| Gen-Name | LOX | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.4.3.13, Oxidoreduktase | |
| Reaktionsart | Oxidative Desaminierung | |
| Substrat | Peptidyl-Lysin + O2 + H2O | |
| Produkte | Peptidyl-Allysin + H2O2 + NH3 + H+ | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Wirbeltiere[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 4015 | 16948 |
| Ensembl | ENSG00000113083 | ENSMUSG00000024529 |
| UniProt | P28300 | P28301 |
| Refseq (mRNA) | NM_001178102 | NM_001286181 |
| Refseq (Protein) | NP_001171573 | NP_001273110 |
| Genlocus | Chr 5: 122.06 – 122.08 Mb | Chr 18: 52.52 – 52.53 Mb |
| PubMed-Suche | 4015 | 16948
|
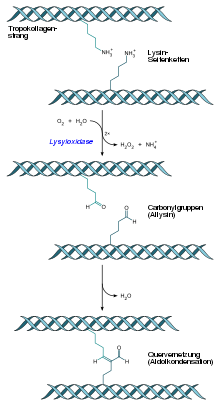
Lysyloxidase, auch als Protein-Lysin-6-Oxidase bezeichnet, ist ein Enzym, das vorwiegend im extrazellulären Raum des Bindegewebes der Wirbeltiere vorkommt. Es katalysiert die oxidative Desaminierung von Lysinresten und ermöglicht dadurch Quervernetzungen in Kollagen und Elastin, wodurch diese Proteine mechanisch stabilisiert werden. Beim Menschen können Kupfermangel und Mutationen im LOX-Gen zur Verringerung der Enzymaktivität und diese zu Cutis laxa führen.[2]
- ↑ PROSITE documentation PDOC007176. Swiss Institute of Bioinformatics (SIB), abgerufen am 20. September 2011 (englisch).
- ↑ UniProt P28300