
Back Swaeldioksied Afrikaans Schwefeldioxid ALS ثنائي أكسيد الكبريت Arabic Kükürd qazından təmizlənmə üsulları Azerbaijani قوقرد دیاوکسید AZB Серен диоксид Bulgarian सल्फर डाइऑक्साइड Bihari সালফার ডাইঅক্সাইড Bengali/Bangla Sumpor-dioksid BS Diòxid de sofre Catalan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
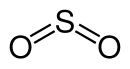
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Schwefeldioxid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | SO2 | |||||||||||||||
| Kurzbeschreibung |
farbloses, stechend riechendes, giftiges Gas[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 64,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−10,05 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
1,000686 (0 °C, 101,325 kPa)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Schwefeldioxid, SO2, ist das Anhydrid der Schwefligen Säure H2SO3. Schwefeldioxid ist ein farbloses, schleimhautreizendes, stechend riechendes und sauer schmeckendes, giftiges Gas. Es ist sehr gut (physikalisch) wasserlöslich und bildet mit Wasser in sehr geringem Maße Schweflige Säure. Es entsteht unter anderem bei der Verbrennung von schwefelhaltigen fossilen Brennstoffen wie Kohle oder Erdölprodukten, die bis zu 4 Prozent Schwefel enthalten. Auch Biomasse enthält je nach Herkunft teils erhebliche Mengen Schwefel, da dieser ein Mengenelement in allen bekannten Lebewesen ist, wodurch bei Verbrennung ebenfalls Schwefeldioxid entsteht. Dadurch trägt es in erheblichem Maß zur Luftverschmutzung bei. Es ist der Grund für sauren Regen, wobei das Schwefeldioxid zunächst von Sauerstoff zu Schwefeltrioxid oxidiert wird und dann mit Wasser zu Schwefelsäure (H2SO4) umgesetzt wird.[9] Um den Eintrag von Schwefeldioxid zu verhindern, gibt es verschiedene Verfahren zur Rauchgasentschwefelung. Zudem findet sich Schwefeldioxid im Umfeld von Hochtemperaturgebieten und aktiven Vulkanen.[10] In den meisten Industrieländern werden Erdöl und Erdgas und daraus entstehende Produkte bereits vor der Verbrennung – zumeist mittels Hydrodesulfurierung – entschwefelt. Auch Biogas wird gemeinhin bei der Biogasaufbereitung vom enthaltenen Schwefelwasserstoff befreit, um ein ungiftigeres und sichereres Produkt zu erhalten. Die Kosten entsprechender Verfahren können – anders als der relativ preisgünstige REA-Gips, welcher kaum die Kosten der Rauchgasentschwefelung deckt – zumeist zu großen Teilen oder gänzlich durch Verwendung der anfallenden Schwefelmengen in der chemischen Industrie gedeckt werden.
- ↑ Eintrag zu E 220: Sulphur dioxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Dezember 2020.
- ↑ a b c d e f Eintrag zu Schwefeldioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2025. (JavaScript erforderlich)
- ↑ a b c Sicherheitsdatenblatt. 21. Dezember 2021, abgerufen am 28. März 2023.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-52.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Gases, S. 10-254.
- ↑ Eintrag zu Sulphur dioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7446-09-5 bzw. Schwefeldioxid), abgerufen am 16. Mai 2020.
- ↑ National Technical Information Service., AD-A148-952.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ H. U. Schmincke: Vulkanismus. Wiss. Buchgesellschaft, Darmstadt 2000, S. 224 ff.



