
Back Swaeldioksied Afrikaans Schwefeldioxid ALS ثنائي أكسيد الكبريت Arabic Kükürd qazından təmizlənmə üsulları Azerbaijani قوقرد دیاوکسید AZB Серен диоксид Bulgarian सल्फर डाइऑक्साइड Bihari সালফার ডাইঅক্সাইড Bengali/Bangla Sumpor-dioksid BS Diòxid de sofre Catalan
| Sulfura dioksido | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| speco de kemiaĵo | |||||||
| sulfura oksido | |||||||
| Ĝeneralaĵoj | |||||||
| Nomo | Sulfura dioksido | ||||||
| Kemia formulo |
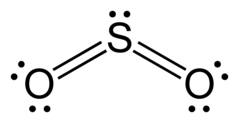
SO₂ | ||||||
| CAS-numero-kodo | |||||||
| PubChem-kodo | 1119 | ||||||
| ChemSpider-kodo | |||||||
| SMILES |
O=S=O
| ||||||
| Karakterizaĵoj | |||||||
| Molmaso |
64.066 g/mol | ||||||
| Fazo de materio | gaso | ||||||
| Denseco |
2,6288 g/L | ||||||
| Sekurecaj indikoj | |||||||
| |||||||
| Se eble, uziĝu unuoj de la Sistemo Internacia de Unuoj. Escepte de la notoj alie indikitaj, la datumoj rilatas al materialoj laŭ la ordinaraj normoj pri temperaturo kaj premo (25o kaj premo je 1 atmosfero aŭ 760 mm de Hg). | |||||||
Sulfura dioksido aŭ dioksido de sulfuro, molekula formulo SO2, estas anhidrido de la sulfita acido H2SO3. Sulfura dioksido estas senkolora, akre odoranta kaj acide gustanta, venena gaso. Ĝi ekestas precipe per la bruligo de sulfurentenanta fosila brulaĵoj kiel karbo aŭ naftoproduktoj, kiuj entenas ĝis 4 procentojn da sulfuro. Sulfura dioksido kontribuas je konsiderinda parto al la aerpoluado, ĝi estas la kaŭzo de acida pluvo, dum kiu la sulfurdioksido kun la akvo kombiniĝas al sulfita acido (H2SO3). Por malebligi tion ekzistas diversaj procedoj de fumgassensulfurigo.
Ĝi estas liberigita nature per vulkana agado kaj estas produktita kiel kromprodukto dum kupro-elfosado kaj dum bruligado de fosiliaj brulaĵoj poluitaj kun sulfuraj komponaĵoj.


