
Back ستربتوكاينيز Arabic Streptokináza Czech Streptokinase German Streptokinase English Estreptoquinasa Spanish استرپتوکیناز Persian Streptokinaasi Finnish Ստրեպտոկինազ Armenian Streptokinase ID Streptochinasi Italian
| Streptokinase | |
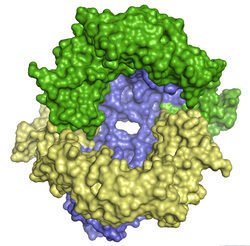 Trois domaines d'une streptokinase C humaine cristallisée (PDB 1BML[1]) |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.667 |
| No CE | 232-647-1 |
| No RTECS | OB8880000 |
| Code ATC | B01 B06 |
| DrugBank | DB00086 |
| Propriétés chimiques | |
| Formule | C2100H3278N566O669S4 |
| Masse molaire[2] | 47 286,148 ± 2,243 g/mol C 53,34 %, H 6,99 %, N 16,77 %, O 22,64 %, S 0,27 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
La streptokinase (SK) est une protéine de 414 résidus d'acides aminés synthétisée par plusieurs espèces de streptocoques qui a la propriété de se lier au plasminogène humain. On l'utilise comme médicament thrombolytique efficace et bon marché dans certains cas d'infarctus du myocarde[3] (crises cardiaques) et d'embolie pulmonaire[4]. Elle fait partie d'une classe de médicaments appelée fibrinolytiques, et les complexes de streptokinases avec le plasminogène humain peuvent activer d'autres plasminogènes non liés par protéolyse pour donner de la plasmine.
La streptokinase est organisée en trois domaines, notés α (résidus 1 à 150), β (résidus 151 à 287) et γ (résidus 288 à 414), qui se lient chacun au plasminogène mais ne peuvent activer le plasminogène séparément[5].
- ↑ (en) Xiaoqiang Wang, Xinli Lin, Jeffrey A. Loy, Jordan Tang et Xuejun C. Zhang, « Crystal Structure of the Catalytic Domain of Human Plasmin Complexed with Streptokinase », Science, vol. 281, no 5383, , p. 1662-1665 (PMID 9733510, DOI 10.1126/science.281.5383.1662, lire en ligne)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Nikhil Sikri et Amit Bardia, « A History of Streptokinase Use in Acute Myocardial Infarction », Texas Heart Institute Journal, vol. 34, no 3, , p. 318-327 (PMID 17948083, PMCID 1995058, lire en ligne)
- ↑ (en) N. Meneveau, F. Schiele, A. Vuillemenot, B. Valette, G. Grollier, Y. Bernard et J.-P. Bassand, « Streptokinase vs alteplase in massive pulmonary embolism. A randomized trial assessing right heart haemodynamics and pulmonary vascular obstruction », European Heart Journal, vol. 18, no 7, , p. 1141-1148 (PMID 9243149, DOI 10.1093/oxfordjournals.eurheartj.a015410, lire en ligne)
- ↑ (en) Lakshmi V. Mundada, Mary Prorok, Melanie E. DeFord, Mariana Figuera, Francis J. Castellino et William P. Fay, « Structure-Function Analysis of the Streptokinase Amino Terminus (Residues 1–59) », Journal of Biological Chemistry, vol. 278, no 27, , p. 24421-24427 (PMID 12704199, DOI 10.1074/jbc.M301825200, lire en ligne)