
Back Atoom Afrikaans Atom ALS አቶም Amharic Atomo AN Mot ANG Atọm ANN परमाणु ANP ذرة Arabic درة ARY ذره ARZ
In atoom is it lytste skaaimerkende boustientsje fan in skiekundich elemint. Elk elemint hat syn eigen soarte atoom. Neffens de klassike atoomteory fan Dalton (om 1800 hinne) binne atomen ûndielbere hurde boltsjes, elk mei har eigen massa. Dy gedachte waard befestige troch eksperiminten. As je stoffen ferhitte of der op in oare wize energy oan tafoegje (ljocht of elektryske stroom) feroarje se yn oare stoffen. Dat komt, omdat de boustientsjes fan dy stoffen (molekulen) stikkenmakke wurde yn lytsere brokjes. Guon stoffen kinne net op dy wize feroare wurde, dat binne de eleminten.
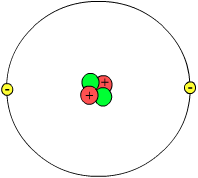
Yn de moderne atoomteory (begûn om 1900 hinne) is it idee dat atomen hurde ûndielbere boltsjes binne loslitten en wurdt ferûndersteld dat atomen foar it grutste part hol binne en opboud út lytsere elemintêre dieltsjes, protoanen, neutroanen en elektroanen . De earste twa foarmje in lytse hurde 'pit' yn it atoom, de atoomkearn. De lêste draaie op sekere ôfstân om dy kearn hinne. Elektroanen hawwe yn fergeliking mei protoanen en neutroanen in folle lytsere massa. Sa goed as alle massa fan in atoom sit dus yn de kearn gearpakt.
It krusiale eksperimint dat late ta it nije konsept fan in hol atoom mei in kearn waard útfierd troch Ernest Rutherford yn 1911. Lettere eksperiminten toanden oan dat ek protoanen en neutroanen op har bar wer opboud binne út noch lytsere dieltsjes.