
Back أنانداميد Arabic آناندامید AZB Анандамид Bulgarian অ্যানান্ডামাইড Bengali/Bangla Anandamid BS Anandamid Czech Anandamid German Anandamide English Anandamida Spanish آناندامید Persian
| Anandamida | |
|---|---|
 | |
Outros nomes N-araquidonoiletanolamina | |
| Identificadores | |
| Número CAS | 94421-68-8 |
| PubChem | 5281969 |
| ChemSpider | 4445241 |
| UNII | UR5G69TJKH |
| MeSH | Anandamide |
| ChEBI | CHEBI:2700 |
| ChEMBL | CHEMBL15848 |
| Ligando IUPHAR | 2364 |
| Imaxes 3D Jmol | Image 1 Image 2 |
| |
| |
| Propiedades | |
| Fórmula molecular | C22H37NO2 |
| Masa molecular | 347,53 g/mol |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
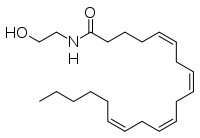
A anandamida (ANA), tamén chamada N-araquidonoiletanolamina (AEA), unha N-aciletanolamina (NAE), é un ácido graxo neurotransmisor. A anandamida foi o primeiro endocannabinoide que se descubriu. Paricipa no sistema endocannabinoide do corpo uníndose a receptores de cannabinoides, os mesmos receptores sobre os que actúa o composto psicoactivo THC do cánnabis. A anandamida encóntrase en case todos os tecidos nun ampla variedade de animais.[1][2] A anandamida tamén se atopou en plantas, e hai pequenas cantidades no chocolate.[3] O nome 'anandamida' tomouse da palabra do sánscrito ananda, que significa "alegría, felicidade, pracer", e a terminación amida.[1][4]
A anandamida deriva do metaboismo non oxidativo do ácido araquidónico, un ácido graxo omega-6 esencial. Sintetízase a partir da N-araquidonoil fosfatidiletanolamina por múltiples vías.[5] É degradada principalmente polo encima amida de ácido graxo hidrolase (FAAH), que converte a anandamida en etanolamina e ácido araquidónico. En consecuencia, os inhibidores da FAAH causan unha elevación dos niveis de anandamida e búscase utilizalos terapeuticamente.[6][7]
A anandamida está sendo investigada polo seu papel na neuroptía diabética/neuropatía, xa que os cannabinoides e as anandamidas exóxenas e endóxenas demostran propiedades antinociceptivas de amplo espectro nun modelo de neuropatía diabética dolorosa, orixinadas pola activación periférica dos dous receptores cannabinoides, é dicir, o CB1 e o CB2,[8][9] ademais da implicación de canles de receptor transitorio vainilloide tipo-1 (TRPV1) na modulación da dor, xa que a sinalización dos endovainilloides modula a dor local,[10] así como na redución da inflamación asociada coa insuficiencia renal.[11]
- ↑ 1,0 1,1 Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. (decembro de 1992). "Isolation and structure of a brain constituent that binds to the cannabinoid receptor". Science 258 (5090): 1946–1949. Bibcode:1992Sci...258.1946D. PMID 1470919. doi:10.1126/science.1470919.
- ↑ Martin BR, Mechoulam R, Razdan RK (1999). "Discovery and characterization of endogenous cannabinoids". Life Sciences 65 (6–7): 573–595. PMID 10462059. doi:10.1016/S0024-3205(99)00281-7.
- ↑ di Tomaso E, Beltramo M, Piomelli D (agosto de 1996). "Brain cannabinoids in chocolate". Nature (Submitted manuscript) 382 (6593): 677–678. Bibcode:1996Natur.382..677D. PMID 8751435. doi:10.1038/382677a0.
- ↑ Mechoulam R, Fride E (1995). "The unpaved road to the endogenous brain cannabinoid ligands, the anandamides". En Pertwee RG. Cannabinoid receptors. Boston: Academic Press. pp. 233–258. ISBN 978-0-12-551460-6.
- ↑ Wang J, Ueda N (setembro de 2009). "Biology of endocannabinoid synthesis system". Prostaglandins & Other Lipid Mediators 89 (3–4): 112–119. PMID 19126434. doi:10.1016/j.prostaglandins.2008.12.002.
- ↑ Gaetani S, Dipasquale P, Romano A, Righetti L, Cassano T, Piomelli D, Cuomo V (2009). "The endocannabinoid system as a target for novel anxiolytic and antidepressant drugs". International Review of Neurobiology 85: 57–72. ISBN 9780123748935. PMID 19607961. doi:10.1016/S0074-7742(09)85005-8.
- ↑ Hwang J, Adamson C, Butler D, Janero DR, Makriyannis A, Bahr BA (abril de 2010). "Enhancement of endocannabinoid signaling by fatty acid amide hydrolase inhibition: a neuroprotective therapeutic modality". Life Sciences 86 (15–16): 615–623. PMC 2848893. PMID 19527737. doi:10.1016/j.lfs.2009.06.003.
- ↑ Schreiber, Anne K.; Neufeld, Manuele; Jesus, Carlos H. A.; Cunha, Joice M. (2012-12-01). "Peripheral antinociceptive effect of anandamide and drugs that affect the endocannabinoid system on the formalin test in normal and streptozotocin-diabetic rats". Neuropharmacology (en inglés) 63 (8): 1286–1297. ISSN 0028-3908. PMID 22959964. doi:10.1016/j.neuropharm.2012.08.009.
- ↑ Ellington, Heather C; Cotter, Mary A; Cameron, Norman E; Ross, Ruth A (2002-06-01). "The effect of cannabinoids on capsaicin-evoked calcitonin gene-related peptide (CGRP) release from the isolated paw skin of diabetic and non-diabetic rats". Neuropharmacology (en inglés) 42 (7): 966–975. ISSN 0028-3908. PMID 12069907. doi:10.1016/S0028-3908(02)00040-0.
- ↑ Silva, M.; Martins, D.; Charrua, A.; Piscitelli, F.; Tavares, I.; Morgado, C.; Di Marzo, V. (2016-08-01). "Endovanilloid control of pain modulation by the rostroventromedial medulla in an animal model of diabetic neuropathy". Neuropharmacology (en inglés) 107: 49–57. ISSN 0028-3908. PMID 26965218. doi:10.1016/j.neuropharm.2016.03.007.
- ↑ Schreiber, Anne K.; Neufeld, Manuele; Jesus, Carlos H. A.; Cunha, Joice M. (2012-12-01). "Peripheral antinociceptive effect of anandamide and drugs that affect the endocannabinoid system on the formalin test in normal and streptozotocin-diabetic rats". Neuropharmacology (en inglés) 63 (8): 1286–1297. ISSN 0028-3908. PMID 22959964. doi:10.1016/j.neuropharm.2012.08.009.