
Back Immunoglobulin domain English Dominio Ig Italian 免疫グロブリンフォールド Japanese Имуноглобулински домен Macedonian Splot immunoglobulinowy Polish Imunoglobulinski domen Serbo-Croatian Imunoglobulinski domen Serbian
| Dominio de inmunoglobulina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
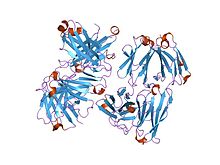 Estrutura dun fragmento de unión ao antíxeno dun anticorpo. | |||||||||
| Identificadores | |||||||||
| Símbolo | ig | ||||||||
| Pfam | PF00047 | ||||||||
| Pfam clan | CL0011 | ||||||||
| InterPro | IPR013151 | ||||||||
| PROSITE | PDOC00262 | ||||||||
| SCOPe | 8fab / SUPFAM | ||||||||
| OPM superfamily | 193 | ||||||||
| OPM protein | 5f71 | ||||||||
| CDD | cd00096 | ||||||||
| Membranome | 2 | ||||||||
| |||||||||
O dominio de inmunoglobulina, tamén chamado pregamento ou dobramento de inmmunoglobulina, é un tipo de dominio proteico que consta dun sándwich de dúas capas de 7-9 febras β antiparalelas dispostas en dous láminas β cunha topoloxía de greca,[1][2] que consta duns 125 aminoácidos.
A espiña dorsal do dominio cambia repetidamente entre as dúas láminas β. Tipicamente, o padrón é (forquita β N-terminal na lámina 1)-(forquita β na lámina 2)-(lámina β na lámina 1)-(forquita β C-terminal na lámina 2). Os cruzamentos entre láminas forman un "X", así que as forquitas N- e C-terminais están en fronte unha da outra.
Os membros da superfamilia das inmunoglobulinas encóntranse en centos de proteínas con diferentes funcións. Exemplos son: anticorpos, a quinase muscular xigante titina e as receptor tirosina quinases. Os dominios de tipo inmunoglobulina poden estar implicados en interaccións proteína-proteína e proteína-ligando.[3]
- ↑ Bork P, Holm L, Sander C (setembro de 1994). "The immunoglobulin fold. Structural classification, sequence patterns and common core". J. Mol. Biol. 242 (4): 309–20. PMID 7932691. doi:10.1006/jmbi.1994.1582.
- ↑ Brümmendorf T, Rathjen FG (1995). "Cell adhesion molecules 1: immunoglobulin superfamily". Protein Profile 2 (9): 963–1108. PMID 8574878.
- ↑ Williams AF, Barclay AN (1988). "The immunoglobulin superfamily—domains for cell surface recognition". Annu. Rev. Immunol. 6: 381–405. PMID 3289571. doi:10.1146/annurev.iy.06.040188.002121.