
Back جلوتاثيون Arabic قلوتاتیون AZB Глутатион Bulgarian Glutation BS Glutatió Catalan Glutathion Czech Glutathion German Γλουταθειόνη Greek Glutathione English Glutationo Esperanto
| Glutation | |||
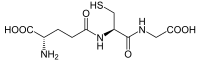
| |||
| IUPAC-név | l-γ-glutamil-l-ciszteinilglicin | ||
| Szabályos név | (2S)-2-amino-5-({(2R)-1-[(karboximetil)amino]-1-oxo-3-szulfanil-2-propanil}amino)-5-oxopentánsav | ||
| Más nevek | GSH, redukált glutation | ||
| Kémiai azonosítók | |||
|---|---|---|---|
| CAS-szám | 70-18-8 | ||
| PubChem | 124886 | ||
| ChemSpider | 111188 | ||
| EINECS-szám | 200-725-4 | ||
| DrugBank | DB00143 | ||
| KEGG | C00051 | ||
| ChEBI | 16856 | ||
| RTECS szám | MC0556000 | ||
| ATC kód | V03AB32 | ||
| Gyógyszer szabadnév | glutathione | ||
| Gyógyszerkönyvi név | Glutathionum | ||
| |||
| |||
| Beilstein | 1729812 | ||
| ChEMBL | 1543 | ||
| Kémiai és fizikai tulajdonságok | |||
| Kémiai képlet | C10H17N3O6S | ||
| Moláris tömeg | 307,32 g/mol | ||
| Megjelenés | fehér por | ||
| Olvadáspont | 193 °C (bomlik) | ||
| Oldhatóság (vízben) | 292,5 g/l | ||
| Megoszlási hányados | −6,4 | ||
| Veszélyek | |||
| MSDS | Science Lab.com | ||
| EU osztályozás | |||
| NFPA 704 | |||
| R mondatok | R68 R36/37/38 | ||
| S mondatok | S24/25 S36/37/39 S27 S26 | ||
| LD50 | 5000 mg/tskg (egér, szájon át) | ||
| Ha másként nem jelöljük, az adatok az anyag standardállapotára (100 kPa) és 25 °C-os hőmérsékletre vonatkoznak. | |||
A glutation (GSH) egy glicinből, ciszteinből és glutaminsavból álló tripeptid, melyben a glicinhez normál peptidkötéssel kötődő cisztein gamma-peptidkötéssel kapcsolódik a glutaminsav oldalláncának karboxilcsoportjához. Jelentőssé teszi a szervezetben antioxidánsként elfoglalt szerepe – ebben a minőségben védi a sejtalkotókat az olyan reaktív oxidáló intermedierektől (ROI), mint a szabad gyökök és a hidrogén-peroxid.[1]
Tiolcsoportja miatt redukálószer, eukarióta (pl. emberi) sejtekben koncentrációja körülbelül 5 mM. Két glutation diszulfid-hidat alkothat, az így képződő oxidálódott termék a glutation-diszulfid (GSSG), vagy l-(–)-glutation.[2]
Az oxidált glutation enzimatikus úton, glutation-reduktázzal alakulhat vissza redukált formájává. A folyamathoz az elektront NADPH szolgáltatja.[3] A GSH:GSSG arány normális esetben a humán sejtekben 500:1,[4] az arány GSSG irányába történő eltolódása a sejt mérgezettségének jele lehet.[5]
- ↑ Pompella, A; Visvikis, A; Paolicchi, A; Tata, V; Casini, AF (2003). "The changing faces of glutathione, a cellular protagonist". Biochemical Pharmacology 66 (8): 1499–503.
- ↑ REACTION: R05267 (KEGG)
- ↑ Couto, Narciso; Malys, Naglis; Gaskell, Simon; Barber, Jill (2013). "Partition and Turnover of Glutathione Reductase from Saccharomyces cerevisiae: a Proteomic Approach". Journal of Proteome Research 12 (6): 2885–94.
- ↑ Ádám V., Dux L. et al. Orvosi biokémia. Szerk. Ádám Veronika. Budapest: Medicina Kiadó. 2004. 248.
- ↑ Pastore, Anna; Piemonte, Fiorella; Locatelli, Mattia; Lo Russo, Anna Lo; Gaeta, Laura Maria; Tozzi, Giulia; Federici, Giorgio (2003). "Determination of blood total, reduced, and oxidized glutathione in pediatric subjects". Clinical Chemistry 47 (8): 1467–9.
