
Back Koolsuur Afrikaans حمض الكربونيك Arabic Karbonat turşusu Azerbaijani کربونیک اسید AZB Вугальная кісьля BE-X-OLD Въглеродна киселина Bulgarian কার্বনিক অ্যাসিড Bengali/Bangla Trenkenn garbonek Breton Ugljična kiselina BS Àcid carbònic Catalan
| Acido carbonico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acido triossocarbonico(IV) | |
| Caratteristiche generali | |
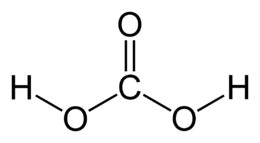
| Formula bruta o molecolare | H2CO3 oppure CO(OH)2 |
| Massa molecolare (u) | 62,03 g/mol |
| Aspetto | Incolore |
| Numero CAS | |
| Numero EINECS | 610-295-3 |
| PubChem | 767, 3614646 e 22639876 |
| SMILES | C(=O)(O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | Ka1: 4,3×10−7 Ka2: 5,60×10−11 |
| Indicazioni di sicurezza | |
L'acido carbonico è un ossiacido diprotico poco stabile in cui l'atomo centrale è il carbonio che in questo composto ha come numero di ossidazione +4. Di fatto non esiste allo stato libero, data la sua tendenza a decomporsi spontaneamente in diossido di carbonio e acqua mentre esistono i suoi sali, i carbonati e gli idrogenocarbonati.
La sua formula chimica ipotetica è H2CO3. Viene reputato il punto d'incontro tra la chimica organica e la chimica inorganica in quanto può essere inteso, in qualche modo, come l'unione di un gruppo ossidrilico (–OH) con un gruppo carbossilico (–COOH). L'acido si forma nell'acqua a partire dal diossido di carbonio per idratazione del gas, ma la velocità di questa reazione è bassa, per cui di fatto l'acido in acqua non esiste in concentrazioni apprezzabili.
Come acido diprotico ha pKa1 = 6,35 ,e pKa2 = 10,3.
