
Back حمض الكلوروز Arabic کولورو اسید AZB ক্লোরাস এসিড Bengali/Bangla Àcid clorós Catalan Kyselina chloritá Czech Хлорла йӳçек CV Chlorige Säure German Χλωριώδες οξύ Greek Chlorous acid English Klorita acido Esperanto
| Acido cloroso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido cloroso | |
| Nomi alternativi | |
| acido diossoclorico(III) | |
| Caratteristiche generali | |
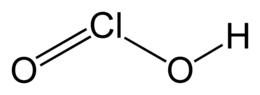
| Formula bruta o molecolare | HClO2 |
| Massa molecolare (u) | 68,46 |
| Aspetto | soluzione acquosa incolore |
| Numero CAS | |
| PubChem | 24453 |
| SMILES | OCl=O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 298 K | 1,1×10−2 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
L'acido cloroso[1] è un ossiacido del cloro trivalente e allo stato di ossidazione +3, avente formula molecolare HClO2 e formula semistrutturale HO−Cl=O. L'anione ClO2− derivante dalla sua dissociazione (base coniugata) viene detto clorito, nome che si applica anche ai suoi sali, i cloriti.[2]
Tra gli acidi alogenosi HXO2 questo è l'unico noto[3] ed è anche il meno stabile tra gli ossiacidi del cloro.[4] Come accade anche per l'acido clorico e l'acido ipocloroso, non è noto allo stato puro ma solo nelle sue soluzioni acquose, nelle quali non può essere concentrato abbastanza senza decomposizione.[5]
Sebbene si comporti da acido debole (pKa = 1,97), è tuttavia più di cinque ordini di grandezza più forte dell'acido ipocloroso (pKa = 7,54).[5]
È un ossidante molto forte e, specialmente in ambiente acido, è il più ossidante degli ossiacidi del cloro [E°(HClO2 / Cl2) = 1,66 V],[6] proprietà questa che è più attenuata per i suoi sali, i cloriti, a pH vicino alla neutralità. Questi ultimi sono utilizzati nella produzione industriale del biossido di cloro.
Tende a dismutare secondo la seguente reazione, e questo lo rende un prodotto non disponibile commercialmente:
- ^ chlorous acid (CHEBI:29219), su ebi.ac.uk. URL consultato il 13 febbraio 2025.
- ^ (EN) PubChem, Chlorite, su pubchem.ncbi.nlm.nih.gov. URL consultato il 6 febbraio 2025.
- ^ James E. House e Kathleen Ann House, Descriptive inorganic chemistry, Third edition, Elsevier/AP, 2016, p. 282, ISBN 978-0-12-804697-5.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 859, ISBN 0-7506-3365-4.
- ^ a b Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, pp. 518-519, ISBN 978-3-11-026932-1.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 855, ISBN 0-7506-3365-4.
