
Back أنهيدريد الأسيتيك Arabic Sirkə anhidridi Azerbaijani استیک انیدرید AZB Воцатны ангідрыд Byelorussian Anhídrid acètic Catalan Acetanhydrid Czech Eddikesyreanhydrid Danish Essigsäureanhydrid German Οξικός ανυδρίτης Greek Acetic anhydride English
| Anidride acetica | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| ossido di etanoile | |
| Nomi alternativi | |
| ossido di acetile | |
| Caratteristiche generali | |
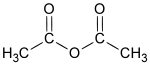
| Formula bruta o molecolare | C4H6O3 |
| Massa molecolare (u) | 102,09 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 203-564-8 |
| PubChem | 7918 |
| SMILES | CC(=O)OC(=O)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,08 |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | −73 °C (200 K) |
| Temperatura di ebollizione | 138 °C (411 K) |
| Tensione di vapore (Pa) a 293 K | 400 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −624,4 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 49 °C (322 K) |
| Limiti di esplosione | 2 - 10,2% vol. |
| Temperatura di autoignizione | 330 °C (603 K) |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 226 - 302 - 331 - 314 - 335 |
| Consigli P | 210 - 260 - 280 - 303+361+353 - 305+351+338 - 312 [1] |
L'anidride acetica è un'anidride organica, ottenuta per condensazione di due molecole di acido acetico. Analogamente alle anidridi inorganiche, per reazione con acqua forma l'acido corrispondente.
A temperatura ambiente è un liquido incolore dall'odore irritante, da manipolare con particolare cautela.
L'anidride acetica è sintetizzata con delle buone rese di reazione facendo reagire cloruro di acetile con acetato di sodio[2][3]
Industrialmente, viene generata in grandi quantità tramite il processo Tennessee Eastman, una variante del processo Monsanto.
Reagisce rapidamente con l'acqua a dare acido acetico, con gli alcoli a dare i corrispondenti esteri acetati e con le ammine a dare le corrispondenti acetammidi.
- ^ scheda della sostanza su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ (EN) Regina Zibuck, Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, Ltd, 15 aprile 2001, pp. ra008, DOI:10.1002/047084289x.ra008, ISBN 978-0-471-93623-7. URL consultato il 17 novembre 2019.
- ^ Vogel, Arthur I. (Arthur Israel), Vogel's Textbook of practical organic chemistry, including qualitative organic analysis., 4th ed., Longman, 1978, p. 499, ISBN 0-582-44250-8, OCLC 3016740. URL consultato il 17 novembre 2019.
