
Back Uraan(VI)fluoried Afrikaans سداسي فلوريد اليورانيوم Arabic هقزافلوراید اورانیوم AZB Hexafluorur d'urani Catalan Fluorid uranový Czech Uran(VI)-fluorid German Uranium hexafluoride English Hexafluoruro de uranio Spanish Uranio hexafluoruro Basque هگزافلوراید اورانیوم Persian
| Esafluoruro di uranio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| esafluoruro di uranio | |
| Nomi alternativi | |
| HEX | |
| Caratteristiche generali | |
| Formula bruta o molecolare | UF6 |
| Peso formula (u) | 352,02 |
| Aspetto | solido incolore-grigio |
| Numero CAS | |
| Numero EINECS | 232-028-6 |
| PubChem | 24560 |
| SMILES | F[U](F)(F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,09 |
| Solubilità in acqua | decomposiz. |
| Temperatura di fusione | 64,8 °C (338 K) a ~1,5 atm |
| Temperatura di ebollizione | 56,5 °C (329,7 K), sublima |
| Tensione di vapore (Pa) a 298 K | 16,7 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −2317 |
| S0m(J·K−1mol−1) | 228 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 330 - 300 - 373 - 411 |
| Consigli P | ---[1] |
L'esafluoruro di uranio (UF6) è un composto impiegato nei processi di arricchimento dell'uranio per la produzione di combustibile nucleare e armi nucleari. A temperatura ambiente si presenta come un solido cristallino da incolore a grigio (evapora a 20 °C); è altamente tossico e reagisce violentemente con l'acqua, svolgendo inoltre un'azione corrosiva su molti metalli.
Viene ottenuto a partire dal minerale di uranio ricco in U3O8 per dissoluzione in acido nitrico a dare nitrato di uranile UO2(NO3)2. Questi viene purificato per estrazione con solvente organico e trattato con ammoniaca a dare il diuranato di ammonio. Per riduzione con idrogeno questi viene convertito in diossido di uranio UO2, convertito successivamente in tetrafluoruro di uranio UF4 e infine ossidato a esafluoruro di uranio per reazione con fluoro.
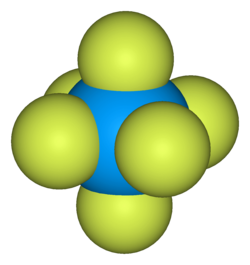
La sua molecola ha geometria ottaedrica, l'atomo di uranio è circondato da sei atomi di fluoro. Chimicamente è un acido di Lewis e un ossidante, capace di formare complessi con altri fluoruri.
- ^ scheda dell'esafluoruro di uranio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.