
Back قانون بويل Arabic Llei de Boyle-Mariotte AST Boyl-Mariott qanunu Azerbaijani Закон Бойля-Марыёта Byelorussian Закон на Бойл – Мариот Bulgarian বয়েলের সূত্র Bengali/Bangla Boyle-Mariotteov zakon BS Llei de Boyle Catalan یاسای بۆیڵ CKB Boyleův–Mariottův zákon Czech

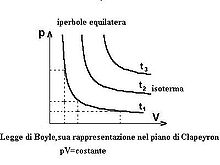
In termodinamica la legge di Boyle e Mariotte o semplicemente legge di Boyle (legge di trasformazione isotermica) afferma che in condizioni di temperatura costante la pressione di un gas perfetto è inversamente proporzionale al suo volume, ovvero che il prodotto della pressione del gas per il volume da esso occupato è costante:[1][2]
oppure:[3]
Tale costante è funzione (crescente) della temperatura assoluta, della natura del gas e del numero di moli.
La legge può essere scritta anche con la seguente notazione più completa:
nella quale viene indicato che la legge vale a temperatura costante, ovvero che la costante varia con la temperatura.
- ^ Silvestroni, p. 160.
- ^ The Penguin Dictionary of Physics.
- ^ (EN) DOE Fundamentals Handbook - "Thermodynamics, Heat transfer, and fluid flow", p. 97. Archiviato il 20 dicembre 2016 in Internet Archive.


