
Back Distikstoftrioksied Afrikaans ثلاثي أكسيد ثنائي النتروجين Arabic دینیتروژن تریاوکسید AZB Triòxid de dinitrogen Catalan Oxid dusitý Czech Dinitrogentrioxid Danish Distickstofftrioxid German Dinitrogen trioxide English Dinitrogena trioksido Esperanto Óxido de nitrógeno(III) Spanish
| Triossido di diazoto | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| trioxido-1κ2O,2κO-dinitrogen(N—N) | |
| Nomi alternativi | |
| anidride nitrosa, ossido di azoto(III) sesquiossido di azoto (arcaico) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O3 |
| Aspetto | solido o liquido blu |
| Numero CAS | |
| Numero EINECS | 234-128-5 |
| PubChem | 61526 |
| SMILES | N(=O)[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,447 |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | -100,7 °C (172,5 K) |
| Temperatura di ebollizione | ~ 3,5 °C (~ 276,6 K) (con dissociazione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
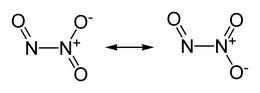
Il triossido di diazoto,[1] nome sistematico ossido di azoto(III) e noto come anidride nitrosa in nomenclatura tradizionale,[2] è un ossido dell'azoto di formula molecolare N2O3 in cui N è allo stato di ossidazione +3 (medio[3]). La sua formula semistrutturale è ON−N(O)2, dove un atomo di azoto è +2 e l'altro +4. Nonostante questa insolita struttura, formalmente è l'anidride dell'acido nitroso,[4] ma si mostra esserlo anche di fatto (vide infra). Questa forma molecolare vale nella condizione più stabile per questo composto, che si ha a basse temperature, sia allo stato solido che in parte allo stato liquido (punto di fusione -100,7 °C, punto di ebollizione ~ 3,5 °C), entrambi di colore azzurro.[5]
Già in parte allo stato liquido, infatti, ma specialmente allo stato di vapore si instaura un equilibrio di dissociazione in monossido di azoto e biossido di azoto e il grado di dissociazione aumenta all'aumentare della temperatura:
La dissociazione e quindi la formazione dei prodotti inizia ad essere apprezzabile a partire da circa -30 °C.[7]
- ^ dinitrogen trioxide (CHEBI:29799), su ebi.ac.uk. URL consultato il 16 febbraio 2024.
- ^ (EN) Dario A. Vitturi, Lucia Minarrieta e Sonia R. Salvatore, Convergence of biological nitration and nitrosation via symmetrical nitrous anhydride, in Nature Chemical Biology, vol. 11, n. 7, 2015-07, pp. 504–510, DOI:10.1038/nchembio.1814. URL consultato il 16 febbraio 2024.
- ^ Al quale numero di ossidazione fa riferimento il nome sistematico.
- ^ (DE) Ralf Steudel, Chemie der Nichtmetalle, 4ª ed., Walter de Gruyter GmbH, 2014, p. 366, DOI:10.1515/9783110307979.
- ^ Greenwood&Earnshaw p. 444
- ^ Greenwood&Earnshaw p. 454
- ^ (DE) Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3ª ed., Springer Spektrum, 2016, p. 566, DOI:10.1007/978-3-662-45067-3, ISBN 978-3-662-45066-6. URL consultato il 15 febbraio 2024.
