
Back Waterstof Afrikaans Wasserstoff ALS ሀይድሮጅን Amharic Hidrocheno AN Wætertimber ANG हाइड्रोजन ANP هيدروجين Arabic هيدروجين ARY هايدروجين ARZ উদজান Assamese
| Vandenilis (H) | |
|---|---|
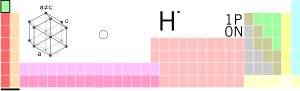
| |
| Periodinė grupė | Dujos |
| Atomo numeris | 1 |
| Išvaizda | Bespalvės dujos
|
| Atomo savybės | |
| Atominė masė (Molinė masė) |
1,00794 а.m.v. (g/mol) |
| Atomo spindulys | 79 pm |
| Jonizacijos energija (pirmas elektronas) |
1311,3 kJ/mol (eV) |
| Elektronų konfigūracija | 1s¹ |
| Cheminės savybės | |
| Kovalentinis spindulys | 32 pm |
| Jono spindulys | 54 (-1e) pm |
| Elektroneigiamumas | 2,20 (pagal Polingą) |
| Elektrodo potencialas | N/A |
| Oksidacijos laipsniai | +1, -1 |
| Termodinaminės savybės | |
| Tankis | 0,0000898 g/cm³ |
| Šiluminė talpa | 14,767 J/(K·mol) |
| Šiluminis laidumas | 0,1815 W/(m·K) |
| Lydymosi temperatūra | 14,01 K |
| Lydymosi šiluma | 0,117 kJ/mol |
| Virimo temperatūra | 20,28 K |
| Garavimo šiluma | 0,904 kJ/mol |
| Molinis tūris | 14,1 cm³/mol |
| Kristalinė gardelė | |
| Kristalinė gardelė | heksagoninė |
| Gardelės periodas | 3,750 Å |
Vandenilis (lot. hydrogenium) – cheminis elementas periodinėje elementų lentelėje, žymimas H. Vandenilio atominis skaičius – 1, tai pats lengviausias ir labiausiai paplitęs elementas visatoje. Normaliomis sąlygomis tai bespalvės, bekvapės, itin degios dviatomės dujos.
Vandenilis – sudedamoji vandens dalis, vandenilio yra kiekvienoje organinėje medžiagoje ir kiekviename organizme. Vandenilis gali reaguoti su dauguma kitų elementų.
Vandenilis yra plačiausiai paplitęs cheminis elementas Visatoje.[1] Žvaigždės pagrindinėse sekose daugiausia sudarytos iš vandenilio, kuris čia randamas plazmos pavidalu. Tačiau elementinis vandenilis yra palyginti retas Žemėje, pvz., vandenyje vandenilio yra 11,1 %, o molyje – 1,5 %.[2] Pramoniniu būdu šis elementas gaunamas iš angliavandenilių, tokių kaip metanas, kurio daug randama gamtinėse dujose ir naftoje. Taip pat vandenilį galima gauti elektrolizuojant vandenį, tačiau tokia gavyba kainuoja daug brangiau nei gavimas iš gamtinių dujų.[3]
- ↑ Palmer, David (1997-09-13). „Hydrogen in the Universe“. NASA. Nuoroda tikrinta 2008-02-05.
- ↑ Zita Dzedulionienė. Chemija: vadovėlis VIII–X klasei: suaugusiųjų ir savarankiškam mokymuisi. Kaunas: Šviesa, 2009, 101 p. ISBN 978-5-430-05433-5.
- ↑ Staff (2007). „Hydrogen Basics - Production“. Florida Solar Energy Center. Nuoroda tikrinta 2008-02-05.