Back حمض اللبنيك Arabic Ácidu láctico AST اسید لاکتیک AZB Малочная кіслата Byelorussian Малочная кісьля BE-X-OLD Млечна киселина Bulgarian Mliječna kiselina BS Àcid làctic Catalan Kyselina mléčná Czech Сĕт йӳçекĕ CV
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC pilihan
Asid 2-hidroksipropanoik 2-Hydroxypropanoic acid | |||
| Nama lain
Asid susu
Milk acid | |||
| Pengecam | |||
| |||
Imej model 3D Jmol
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.017 | ||
| Nombor E | E270 (bahan pengawet) | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| C3H6O3 | |||
| Jisim molar | 90.08 g·mol−1 | ||
| Takat lebur | 53°C | ||
| Takat didih | 122 °C (252 °F; 395 K) @ 15 mmHg | ||
| Larut campur[1] | |||
| Keasidan (pKa) | 3.86,[2] 15.1[3] | ||
| Termokimia | |||
Entalpi pembakaran
piawai (ΔcH⦵298) |
1361.9 kJ/mol, 325.5 kcal/mol, 15.1 kJ/g, 3.61 kcal/g | ||
| Farmakologi | |||
| Kod ATC | G01AD01 QP53AG02 (WHO) | ||
| Bahaya | |||
| Piktogram GHS | Templat:GHSp[4] | ||
| H315, H318[4] | |||
| P280, P305+351+338[4] | |||
| Sebatian berkaitan | |||
Anion lain
|
laktat | ||
asid karboksilik berkaitan
|
asid asetik asid glikolik asid propionik asid 3-hidroksipropanoik asid malonik asid butirik asid hidroksibutirik | ||
Sebatian berkaitan
|
1-propanol 2-propanol propionaldehid akrolein natrium laktat | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| Rujukan kotak info | |||
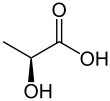
Asid laktik adalah sebatian organik dengan formula CH3CH(OH)COOH. Ia berwarna putih dan larut dalam air dalam bentuk pejalnya manakala cecair, kelihatan tidak berwarna. Ia dihasilkan secara semulajadi mahupun secara sintetik. Kedudukan kumpulan hidroksilnya yang bersebelahan dengan kumpulan karboksil menjadikan asid ini dikelaskan sebagai sebuah asid alfa-hidroksi (AHA). Bentuk bes konjugatnya, iaitu laktat, memainkan peranan dalam beberapa proses biokimia.
Bentuk larutannnya boleh mengionkan satu proton dari kumpulan karboksil, menghasilkan ion laktat CH3CH(OH)CO−
2. Dibandingkan dengan asid asetik, pKanya bernilai kurang 1 unit. Hal ini bermakna asid laktik dinyahprotonkan sepuluh kali lebih mudah daripada asid asetik. Tahap keasidan yang lebih tinggi ini disebabkan ikatan hidrogen dalam molekul antara kumpulan-kumpulan hidroksil dan karboksilat.
- ^ Templat:GESTIS
- ^ Dawson, R. M. C. (1959). Data for Biochemical Research. Oxford: Clarendon Press. Unknown parameter
|displayauthors=ignored (bantuan) - ^ Silva, A. M.; Kong, X.; Hider, R. C. (2009). "Determination of the pKa value of the hydroxyl group in the alpha-hydroxycarboxylates citrate, malate and lactate by 13C NMR: implications for metal coordination in biological systems". Biometals. 22 (5): 771–778. doi:10.1007/s10534-009-9224-5. PMID 19288211.
- ^ a b c Sigma-Aldrich Co., DL-Lactic acid. Dicapai pada 2013-07-20.