Back Diasetil Azerbaijani دیاستیل AZB Butan-2,3-diona Catalan Diacetyl Czech Diacetyl German Diacetyl English Duacetilo Esperanto Diacetilo Spanish دیاستیل Persian Diasetyyli Finnish
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C4H6O2 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
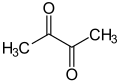
Ac−Ac, CH | ||||||||||||||||||||||||||||||||||||
| Masa molowa |
86,09 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna ciecz o silnym zapachu podobnym do chloru | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
Diacetyl, 2,3-butanodion, dimetyloglioksal, CH
3COCOCH
3 – organiczny związek chemiczny zbudowany z dwóch grup acetylowych (Ac−Ac). Najprostszy diketon wicynalny (tj. zawierający dwie grupy ketonowe w pozycjach sąsiednich). Żółta ciecz wrząca w 88 °C. Występuje w maśle i olejkach eterycznych. Stosowany w przemyśle spożywczym, nadaje potrawom maślany smak. Powstaje naturalnie w procesie produkcji piwa. Jest obecny zwłaszcza w młodych piwach. W małych stężeniach jest pożądany w takich gatunkach piwa jak np. scotch ale, dry stout, english bitter lub oktoberfest, jeśli jednak występuje w większych ilościach, psuje aromat piwa nieprzyjemnym zapachem masła[7][8][niewiarygodne źródło?][9]. Może powodować zarostowe zapalenie oskrzelików[10]. Rozcieńczony wodny roztwór diacetylu daje pozytywny wynik w próbie jodoformowej.
- ↑ a b c d e Haynes 2016 ↓, s. 3-76.
- ↑ a b c d Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSABŁĄD PRZYPISÓW - ↑ Haynes 2016 ↓, s. 5-142.
- ↑ a b Haynes 2016 ↓, s. 16-18.
- ↑ a b Haynes 2016 ↓, s. 6-100.
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieSA-USBŁĄD PRZYPISÓW - ↑ Dwuacetyl / diacetyl (0620), [w:] Paweł Leszczyński, Opis cech sensorycznych piwa, Polskie Stowarzyszenie Piwowarów Domowych, s. 2 [dostęp 2024-01-13].
- ↑ Diacetyl [online], Wiki piwo.org [dostęp 2015-01-01].
- ↑ Andrzej Sadownik, Diacetyl w przelocie, „Piwowar”, 13, zima 2013, s. 22, ISSN 2082-4874.
- ↑ P. Kovacic, A.L. Cooksy, Electron transfer as a potential cause of diacetyl toxicity in popcorn lung disease, „Reviews of Environmental Contamination and Toxicology”, 204, 2010, s. 133–148, DOI: 10.1007/978-1-4419-1440-8_2, PMID: 19957235.