
Back Ammoniak Afrikaans أمونيا Arabic أمونياك ARY এম’নিয়া Assamese Amoniacu AST Ammonyak Azerbaijani آمونیاک AZB Amonya BCL Аміяк Byelorussian Аміяк BE-X-OLD
| Acest articol sau această secțiune are bibliografia incompletă sau inexistentă. Puteți contribui prin adăugarea de referințe în vederea susținerii bibliografice a afirmațiilor pe care le conține. |
| Amoniac | |
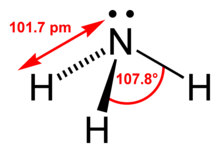 Structura moleculei de amoniac | |
 | |
| Denumiri | |
|---|---|
| Alte denumiri | Soluție de amoniac |
| Identificare | |
| Număr CAS | 7664-41-7 |
| ChEMBL | CHEMBL1160819 |
| PubChem CID | 222 |
| Informații generale | |
| Formulă chimică | NH3 |
| Aspect | gaz incolor |
| Masă molară | 17 g/mol |
| Proprietăți | |
| Densitate | 0,7198 kg/m3 |
| Starea de agregare | gaz |
| Punct de topire | -77,73 |
| Punct de fierbere | -33,5 |
| Solubilitate | 541 g/l |
| Anion | Azot |
| Cation | Hidrogen |
| Duritate (Scara Mohs) | - |
| Presiune de vapori | 8,5 atm[2] |
| NFPA 704 | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Amoniacul este un compus chimic format dintr-un atom de azot și trei atomi de hidrogen. Denumirea provine de la clorura de amoniu, care a fost pentru prima dată descoperită în „Oaza lui Ammon” azi „Oaza Siwa”, Egipt. Starea de agregare a amoniacului fiind gazoasă, având proprietățile chimice unei baze, toxice cu miros înțepător, mai ușor ca aerul.
Amoniacul are un important rol, fiind precursor sau constituent al multor compuși organici, printre care se numără: aminele, amidele, aminoacizii (și de aici peptide, proteine) etc.
