
Back Nitroësuur Afrikaans حمض النتروز Arabic Nitrit turşusu Azerbaijani نیترو اسید AZB Азоцістая кіслата Byelorussian Азотиста киселина Bulgarian নাইট্রাস অ্যাসিড Bengali/Bangla Àcid nitrós Catalan Kyselina dusitá Czech Азотла йӳçек CV
| Azotasta kiselina | |||
|---|---|---|---|
| |||
Nitrous acid | |||
| Naziv po klasifikaciji | Hidroksidooksidoazot | ||
| Identifikacija | |||
| CAS registarski broj | 7782-77-6 | ||
| PubChem[1][2] | 24529 | ||
| ChemSpider[3] | 22936 | ||
| EINECS broj | |||
| KEGG[4] | |||
| MeSH | |||
| ChEBI | 25567 | ||
| ChEMBL[5] | CHEMBL1161681 | ||
| Gmelin Referenca | 983 | ||
| 3DMet | B00022 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
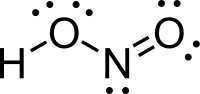
| Molekulska formula | HNO2 | ||
| Molarna masa | 47.013 g/mol | ||
| Agregatno stanje | bledo plavi rastvor | ||
| Gustina | Aproksimativno 1 g/ml | ||
| Tačka topljenja |
Poznata je samo u rastvoru | ||
| pKa | 3.398 | ||
| Opasnost | |||
| EU-indeks | nije na listi | ||
| Tačka paljenja | nije zapaljiva | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Azotna kiselina | ||
| Drugi katjoni | Natrijum nitrit Kalijum nitrit Amonijum nitrit | ||
| Srodna jedinjenja | Diazot trioksid | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Azotasta kiselina (nitritna kiselina) je jedinjenje sa molekulskom formulom HNO2). Ona je slaba i monobazina kiselina koja je poznata samo u rastvoru i u obliku nitritnih soli.[6][7]
Azotasta kiselina se koristi za pravljenje diazida iz amina. Do toga dolazi nukleofilnim napadom amina na nitrit, reprotonacijom uz pomoć rastvarača, i dvostrukom eliminacijom u vodi. Diazid se zatim oslobađa i daje karben ili karbenoid.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Housecroft C. E., Sharpe A. G. (2008). Inorganic Chemistry (3rd izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ↑ Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005.