
Back Metaan Afrikaans Metano AN ميثان Arabic Metanu AST Metan Azerbaijani متان AZB Метан Bashkir Metano BCL Метан Byelorussian Мэтан BE-X-OLD
| Metan | |||
|---|---|---|---|
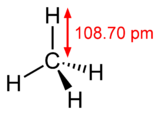 |
 | ||
 |
 | ||
| Drugi nazivi | Metil hidrid, biogas | ||
| Identifikacija | |||
| CAS registarski broj | 74-82-8 | ||
| PubChem[1][2] | 297 | ||
| ChemSpider[3] | 291 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | CH4[4] | ||
| Molarna masa | 16.042 g/mol | ||
| Agregatno stanje | Bezbojni gas | ||
| Gustina | 0.717 kg/m3 (gas, 0 °C) 415 kg/m3 (tečnost) | ||
| Tačka topljenja |
-182.5 °C, 91 K, -297 °F | ||
| Tačka ključanja |
-161.6 °C, 112 K, -259 °F | ||
| Rastvorljivost u vodi | 35 mg/L (17 °C) | ||
| Opasnost | |||
| Opasnost u toku rada | Visoko zapanjiv (F+) | ||
| NFPA 704 | |||
| R-oznake | R12 | ||
| S-oznake | S2, S9, S16, S33 | ||
| Tačka paljenja | -188 °C | ||
| Eksplozivni limiti | 5 – 15% [5] | ||
| Srodna jedinjenja | |||
| Srodna Alkanii | Etan, propan | ||
| Сродна једињења | Metanol, Hlorometan, Mravlja kiselina, formaldehid, silan | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Metan (CH4), poznat i kao blatni gas je najprostiji zasićeni ugljovodonik (alkan). Ukoliko vladaju normalni uslovi on je bezbojan gas.
U prirodi metan nastaje usled bezkiseoničnog raspada organskih materija (npr. močvarama). Metan je glavni sastojak zemnog gasa. Koristi se kao gas za grejanje i kao sirovina za dobijanje organskih jedinjenja
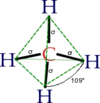
Molekul metana ima oblik tetraedra. Atom ugljenika s ima sp3 hibridizaciju. Ostale orbitale grade hemijsku vezu sa četri atoma vodonika. Sve četri veze su podjednake (uglovi između veza iznose 109°28') i veoma su malo polarizovane, što je zajedno sa nedostatkom slobodnih elektronskih parova velike postojanosti ovog jedinjenja. Metan može da učestvuje samo u reakcijama tipičnim za alkane (npr: sagorjevanje).
Labaratorijski metan se dobija prženjem natrijum acetata sa natrijum hidroksidom:
- CH3COONa + NaOH → CH4 + Na2CO3
Druga metoda je hidroliza aluminijum karbida:
- Al4C3 +12H2O → 3CH4 + 4Al(OH)3
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ „NIST veb knjiga”.
- ↑ „MSDS Methane”. Arhivirano iz originala na datum 2010-12-01. Pristupljeno 2014-04-11.
