
Back Ester Afrikaans إستر Arabic Éster AST Mürəkkəb efirlər Azerbaijani Ester BCL Эстэры Byelorussian Складаныя этэры BE-X-OLD Естер Bulgarian Ester BS Èster Catalan
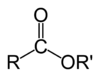

Estri (nem. Essig-Äther, što je stari naziv za etil-etanoat) organska su jedinjenja koja u svojim molekulima sadrže ostatak molekula kiseline i ostatak molekula alkohola.[1] Estri daju miris voću, povrću i četinarima. Njihova opšta formula je: CnH2n+1-COO-CnH2n+1. U hemiji, estar je funkcionalna grupa izvedena iz kiseline (organske ili neorganske) u kojoj je atom vodonika (H) najmanje jedne kisele hidroksilne grupe (−OH) te kiseline zamenjen organskom grupom (R′) . Analogi dobijeni od kiseonika zamenjenog drugim halkogenima takođe pripadaju kategoriji estara.[2] Prema nekim autorima, organski derivati kiselog vodonika drugih kiselina su takođe estri (npr. amidi), ali ne prema IUPAC.[2]
Estri dobijaju nazive u zavisnosti od toga koji je alkohol i koja kiselina izreagovala. Ako je recimo, reagovao etanol i etanska kiselina, dobija se estar koji se naziva etil-etanoat ili etil-acetat. Taj naziv je izveden od etil-grupe alkohola i naziva soli etanske kiseline. Soli etanske kiseline se nazivaju etanoati ili acetati.
- CH3-COOH + CH3-CH2-OH → CH3-COO-CH2-CH3 + H2O
Estri se dobijaju u reakciji esterifikacije. Ta se reakcija odvija u kiseloj sredini. Suprotna reakcija esterifikaciji je hidroliza. U toj reakciji se dobijena voda iz esterifikacije jedini sa estrom koji je dobijen i daje polazne supstance: alkohol i kiselinu.
- CH3-COO-CH2-CH3 + H2O → CH3-COOH + CH3-CH2-OH
Estri se koriste u prehrambenoj industriji za proizvodnju veštačkih mirisa, kao rastvarači boja, lakova i kao sirovina za dobijanje veštačkih vlakana. Jedan od najpoznatijih estara je nitroglicerin, koji se dobija reakcijom trovalentnog alkohola glicerola i azotne kiseline, uz prisustvo sumporne kiseline.[3][4][5]
Gliceridi su estri masnih kiselina i glicerola; oni su važni u biologiji, jer su jedna od glavnih klasa lipida i čine većinu životinjskih masti i biljnih ulja. Laktoni su ciklični karboksilni estri; Prirodni laktoni su uglavnom 5- i 6-člani laktoni u prstenu. Laktoni doprinose aromi voća, putera, sira, povrća poput celera i druge hrane.
Estri se mogu formirati od oksokiselina (npr. estri sirćetne kiseline, ugljene kiseline, sumporne kiseline, fosforne kiseline, azotne kiseline, ksantične kiseline), ali i od kiselina koje ne sadrže kiseonik (npr. estri tiocijanske kiseline i tritiokarbonske kiseline). Primer formiranja estra je reakcija supstitucije između karboksilne kiseline (R−C(=O)−OH) i alkohola (R'−OH), formirajući estar (R−C(=O)−O−R'), gde R predstavlja bilo koju grupu (obično vodonik ili organil), a R′ označava organil grupu.
Organil estri karboksilnih kiselina obično imaju prijatan miris; oni male molekularne težine se obično koriste kao mirisi i nalaze se u eteričnim uljima i feromonima. Oni deluju kao rastvarači visokog kvaliteta za široku lepezu plastike, plastifikatora, smola i lakova,[6] i predstavljaju jednu od najvećih klasa sintetičkih maziva na komercijalnom tržištu.[7] Poliesteri su važne plastike, sa monomerima povezanim estarskim delovima. Estri fosforne kiseline čine kičmu molekula DNK. Estri azotne kiseline, kao što je nitroglicerin, poznati su po svojim eksplozivnim svojstvima.
Postoje jedinjenja u kojima kiseli vodonik kiselina navedenih u ovom članku nije zamenjen organilom, već nekom drugom grupom. Prema nekim autorima, ta jedinjenja su estri, posebno kada je prvi atom ugljenika organske grupe koja zamenjuje kiseli vodonik, zamenjen drugim atomom iz grupe 14 elemenata (Si, Ge, Sn, Pb); na primer, prema njima, trimetilstanil acetat (ili trimetilkalaj acetat) CH
3COOSn(CH
3)
3 je trimetilstanil estar sirćetne kiseline i dibutilkalaj dilaurat (CH
3(CH
2)
10COO)
2Sn((CH
2)
3CH
3)
2 je dibutilstanilenski estar laurinske kiseline, a Filipsov katalizator CrO
2(OSi(OCH
3)
3)
2 je trimetoksisilil estar hromne kiseline (H
2CrO
4).[8][9]
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ а б IUPAC. „esters”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. . London: Academic Press. 2000. ISBN 978-0-12-361811-5.
- ^ Nelson D. L., Cox M. M. (2013): Lehninger Principles of Biochemistry. . W. H. Freeman and Co. ISBN 978-1-4641-0962-1.
- ^ Hall J. E., Guyton A. C. (2006): Textbook of medical physiology, 11th edition. Elsevier Saunders, St. Louis, Mo. ISBN 978-0-7216-0240-0.
- ^ Cameron Wright (1986). A worker's guide to solvent hazards. The Group. стр. 48. ISBN 9780969054542.
- ^ E. Richard Booser (21. 12. 1993). CRC Handbook of Lubrication and Tribology, Volume III: Monitoring, Materials, Synthetic Lubricants, and Applications. CRC. стр. 237. ISBN 978-1-4200-5045-5.
- ^ „Acetoxytrimethyltin”.
- ^ „Trimethyltin acetate | C5H12O2Sn | ChemSpider”.