
Back Nitraat Afrikaans نترات Arabic Nitratu AST Nitratlar Azerbaijani نیترات AZB Нітраты Byelorussian Нитрат Bulgarian নাইট্রেট Bengali/Bangla Nitrat Breton Nitrat BS
| Den här artikeln behöver fler eller bättre källhänvisningar för att kunna verifieras. (2022-07) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |
| nitrat | |
 | |
| Systematiskt namn | nitrat |
|---|---|
| Kemisk formel | NO3- |
| Molmassa | 62.00 g/mol |
| SI-enheter & STP används om ej annat angivits | |
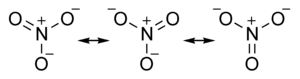
Nitrater är, inom den oorganiska kemin, salter av nitratjonen. Nitratjonen är en sammansatt jon med den kemiska beteckningen NO3-.
Nitratjoner bildas när nitrifikationsbakterier omvandlar ammoniumjoner NH4+ till nitritjoner och sedan vidare till nitratjoner. Nitratjonerna kan sedan omvandlas till kvävgas genom denitrifikation av fakultativt anaeroba bakterier.
Alla metallnitrat är lösliga i vatten. Vissa nitrater är flyktiga, till exempel kopparnitrat (Cu(NO3)2) och kvicksilvernitrat (Hg(NO3)2). Vid upphettning sönderfaller metallnitrat vanligen till metalloxid och kvävedioxid, undantaget natrium- och kaliumnitrat som bildar motsvarande metallnitrit och syre. Ammoniumnitrat sönderdelas vid upphettning till lustgas och vattenånga. Ett viktigt exempel på ett organiskt nitrat är nitroglycerin, som används både inom medicinen och sprängmedelsindustrin.