
Back برولين Arabic Prolin Azerbaijani پرولین AZB Пролин Bulgarian প্রোলিন Bengali/Bangla Prolin BS Prolina Catalan Prolin Czech Prolin Danish Prolin German
| Prolin | |
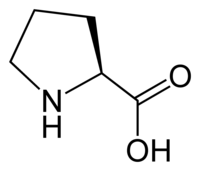  | |
| Systematiskt namn | Pyrrolidin-2-karboxylsyra |
|---|---|
| Kemisk formel | C5H9NO2 eller C4H8NCOOH |
| Molmassa | 115,1305 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 609-36-9 |
| SMILES | C1CCNC1C(=O)O |
| Egenskaper | |
| Densitet | 1,36 g/cm³ |
| Löslighet (vatten) | 1500 g/l |
| Smältpunkt | 220 °C (sönderfaller) |
| SI-enheter & STP används om ej annat angivits | |
Prolin (förkortas Pro eller P) är kemisk förening[1] med summaformeln C5H9NO2. Ämnet är en av de 20 aminosyrorna som är byggstenar i proteiner. Ämnet tillhör gruppen neutrala, hydrofoba, opolära aminosyror.
Dess uppbyggnad skiljer sig något från de övriga genom att "R(e)-gruppen" även är bunden till amingruppen, detta bidrar till att ge en stabil struktur åt proteinet. Se artikeln för aminosyror.
I den genetiska koden kodas prolin av fyra kodon: CCU, CCC, CCA och CCG.
Till skillnad från de flesta andra aminosyror har prolin en cyklisk struktur där aminogruppen är bunden till sidokedjan istället för att vara separerad som en fristående grupp. Detta ger prolin en mer kompakt tredimensionell form. Den cykliska strukturen gör också prolins kväve oladdad, vilket skiljer sig från de flesta andra aminosyrorna. Dessa strukturella egenheter påverkar de proteiner som prolin ingår i och hur de veckar sig. Biosyntesen av prolin sker från aminosyran glutamat via flera steg där enzymer som pyrrolin-5-karboxylatsyntetas och prolinaminotransferas är inblandade. Vitaminet B6 fungerar som en kosymbions i denna process.
Prolin spelar en kritisk roll i strukturen av proteiner, särskilt i kollagen, där den bidrar till att bilda stabila trippelhelixar. Kollagen är ett huvudkomponent i bindväv och utgör en stor del av hud, ben, senor och ligament. På grund av dess ringstruktur introducerar prolin en "böj" eller "sväng" i polypeptidkedjor, vilket kan påverka proteiners sekundärstruktur, såsom alfa-helixar och beta-sheets.
- ^ http://www.ne.se/lang/prolin & http://www.ne.se/enkel/aminosyror - från Nationalencyklopedin på nätet - http://www.ne.se - läst datum: 7 april 2014