
Back Kaliumkarbonaat Afrikaans كربونات البوتاسيوم Arabic بوتاس ARZ پوتاسیوم کربونات AZB Калиев карбонат Bulgarian পটাশিয়াম কার্বনেট Bengali/Bangla Carbonat de potassi Catalan Uhličitan draselný Czech Сĕлтĕ мымми CV Potaske Danish
| |
| |

| |
| Adlandırmalar | |
|---|---|
Potasyum karbonat | |
Diğer adlar Potasa, potas, dipotasyum karbonat, inci külü, tartar tuzu | |
| Tanımlayıcılar | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| E numaraları | E501(i) (asitliği düzenleyiciler, ...) |
PubChem CID
|
|
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA)
|
|
| |
| |
| Özellikler | |
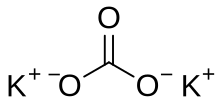
| Molekül formülü | K2CO3 |
| Molekül kütlesi | 138.205 g/mol |
| Görünüm | Beyaz, higroskopik katı |
| Yoğunluk | 2.43 g/cm3 |
| Erime noktası | 891°C |
| Kaynama noktası | Bozunur |
| Çözünürlük (su içinde) | 112 g/100 mL (20°C) 156 g/100 mL (100°C) |
| Çözünürlük | 3.11 g/100 mL (25°C) metanol, alkol, aseton’da çözünmez |
| −59.0•10−6 cm3/mol | |
| Tehlikeler | |
| GHS etiketleme sistemi: | |
| Piktogramlar | 
|
| İşaret sözcüğü | Uyarı |
| Tehlike ifadeleri | H302, H315, H319, H335 |
| Önlem ifadeleri | P261, P305+P351+P338 |
| NFPA 704 (yangın karosu) |
|
| Parlama noktası | Yanmaz |
| Öldürücü doz veya konsantrasyon (LD, LC): | |
LD50 (medyan doz)
|
1870 mg/kg (oral, sıçan)[1] |
| Güvenlik bilgi formu (SDS) | ICSC 1588 |
| Benzeyen bileşikler | |
Diğer anyonlar
|
Potasyum bikarbonat |
Diğer katyonlar
|
Lityum karbonat Sodyum karbonat Rubidyum karbonat Sezyum karbonat |
Benzeyen bileşikler
|
Amonyum karbonat |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |
| Bilgi kutusu kaynakları | |
Potasyum karbonat, K2CO3 formülüne sahip inorganik bileşiktir. Suda çözünen beyaz bir tuzdur. Nem çekerek sıvılaşan ve genellikle nemli veya ıslak bir katı olarak görülür. Potasyum karbonat esas olarak sabun ve cam üretiminde kullanılır.[2]
- ^ Chambers, Michael. "ChemIDplus - 584-08-7 - BWHMMNNQKKPAPP-UHFFFAOYSA-L - Potassium carbonate [USP] - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.sis.nlm.nih.gov. 12 Ağustos 2014 tarihinde kaynağından arşivlendi. Erişim tarihi: 18 Haziran 2020.
- ^ H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039.
