
Back Stoigiometrie Afrikaans تكافؤ ترابط العناصر Arabic Estequiometría AST Стэхіяметрыя Byelorussian Стехиометрия Bulgarian স্টয়কিওমিতি Bengali/Bangla Stehiometrija BS Estequiometria Catalan Stechiometrie Czech Støkiometri Danish
Stokiyometri (/ˌstɔɪkiˈɒmɪtri/ ), kimyasal tepkimelerin öncesinde, tepkime sırasında ve sonrasında reaktif ve ürünlerin miktarları arasındaki ilişkidir.
Stokiyometri, kütlenin korunumu yasası üzerine kuruludur: tepkenlerin miktarları biliniyorsa, ürünün miktarı hesaplanabilir. Tersine, bir tepkenin miktarı biliniyorsa ve ürünlerin miktarı belirlenebiliyorsa, o zaman diğer tepkenlerin miktarı da hesaplanabilir.
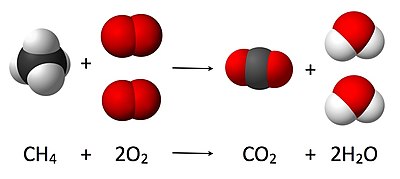
Aşağıda örnek olarak metan gazının yanması verilmiştir:
- CH
4 + 2 O
2 → CO
2 + 2 H
2O
Burada bir molekül metan, iki oksijen molekülü ile tepkimeye girerek bir molekül karbondioksit ve iki molekül su verir. Denklem, bir tam yanma örneğidir. Kimyasal tepkimelere katıldıkları için maddeler arasındaki nicel ilişkileri açıklayan tepkime stokiyometrisi olarak bilinir. Yukarıdaki örnekte, tepkime stokiyometrisi, karbondioksit ve su oluşturmak için tepkimeye giren metan ve oksijen miktarları arasındaki ilişkiyi ölçer.
Mollerin atomik ağırlıklarla iyi bilinen ilişkisi nedeniyle, elde edilen oranlar tanımlanan bir tepkimede ağırlığa göre miktarları belirlemek için kullanılabilir. Buna kompozisyon stokiyometrisi denir.
Gaz stokiyometrisi, gazların belirli bir sıcaklık, basınç ve hacimde olduğu varsayılan ideal şartlar altındaki gazlarla ilgilenir. Gazlar için, ideal gaz yasasına göre hacim oranı ideal olarak aynıdır, ancak tek bir tepkimenin kütle oranı, tepken ve ürünlerin moleküler kütlelerinden hesaplanmalıdır. Pratikte izotopların varlığından dolayı kütle oranı hesaplanırken bunun yerine molar kütleler kullanılır.